Bu ders notumuzda Kimya dersinin Kimyasal Bağlar konusu altında; Kimyasal Bağlar, İyonik Bağlar, Kovalent Bağlar, Apolar Kovalet Bağ, Polar Kovalent Bağlar, Bir Atomun Yapabileceği Bağ Sayısı, Molekül Biçimleri, İkili ve Üçlü Bağlar, Moleküller Arası Bağlar, Metal Bağı vb. başlıklar hakkında detaylı bilgileri bulabilirsiniz.
KİMYASAL BAĞLAR
Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir. Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme yapmak gerekirse bağlar oluşurken dışarıya enerji verirler.
Atomlar bağ yaparken, elektron dizilişlerini soygazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip olduğu veya az enerji ile sahip olabileceği yarı dolu orbital sayısına eşittir.
Soygazların bileşik oluşturamamasının sebebi bütün orbitallerinin dolu olmasındandır.
İYONİK BAĞLAR
İyonik bağlar, metaller ile ametaller arasında metallerin elektron vermesi ametallerin elektron almasıyla oluşan bağlanmadır.
Metaller elektron vererek (+) değerlik, ametaller elektron alarak (–) değerlik alırlar. Bu şekilde oluşan (+) ve (–) yükler birbirini büyük bir kuvvetle çekerler. Bu çekim iyonik bağın oluşumuna sebep olur. Onun için iyonik bağlı bileşikleri ayrıştırmak zordur.
Elektron aktarımıyla oluşan bileşiklerde, kaybedilen ve kazanılan elektron sayıları eşit olmalıdır.
- İyonik katılar belirli bir kristal yapı oluştururlar.
- İyonik bağlı bileşikler oda sıcaklığında katı halde bulunurlar.
- İyonik bileşikler katı halde elektriği iletmez. Sıvı halde ve çözeltileri elektriği iletir.
NaCl, MgS, BaCl2 bileşikleri iyonik bağlı bileşiklere örnek olarak verilebilir.
KOVALENT BAĞLAR
Hidrojenin ametallerle ya da ametallerin kendi aralarında elektronlarını ortaklaşa kullanarak oluşturulan bağa kovalent bağ denir.
a. Apolar Kovalet Bağ
Kutupsuz bağ, yani (+), (-) kutbu yoktur.
| İki hidrojen atomu elektronları ortaklaşa kullanarak bağ oluştururlar. | 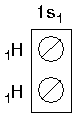 |
| Elektron nokta yapısıyla; | 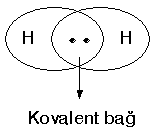 |
şeklinde gösterilir. İki arasındaki bağ H—H şeklinde gösterilir ve H2 şeklinde yazılır.
Aynı cins atomlar arasındaki bağ apolar kovalent bağdır.
b. Polar Kovalent Bağlar
Farklı ametaller arasında oluşan bağa polar kovalent (kutuplu) bağ diyoruz.
Elektronlar iki atom arasında eşit olarak paylaşılmadığından kutuplaşma oluşur ve buna polar kovalent bağ denir. Bu polarlığı HF molekülü ile açıklamaya çalışalım:
| Hidrojen ve Flor elektron ortaklığı ile bileşik oluşturmuş durumdadır. Florun elektron alması yani elektronu kendisine çekme gücü hidrojenden daha fazla olduğundan elektron kısmen de olsa Flor tarafındadır. Dolayısıyle Flor kısmen (-), Hidrojen ise kısmen (+) yüklenmiş olur. Bu olaya kutuplaşma, bu tür bağa polar kovalent bağ denir. | 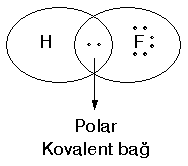 |
BİR ATOMUN YAPABİLECEĞİ BAĞ SAYISI
- Bir atomun yapabileceği bağ sayısı; o un sahip olduğu veya çok az enerji ile sahip olabileceği yarı dolu orbital sayısı kadardır.
- Bir alt yörüngeden bir üst yörüngeye elektron uyarılarak yarı dolu orbital oluşturma çok enerji istediğinden bağ yapmaya elverişli olamaz.
 |
1 bağ yapabilir. |
 |
Orbital tam dolu olduğundan bağ yapamaz. |
 |
Bir tane yarı dolu orbitali vardır. 1 bağ yapabilir. |
 |
2 bağ yapması gerekir. Ancak C’nun 4 bağ yaptığı biliniyor. O halde uyarılmış durumda; |
 |
4 tane yarı dolu orbital olur. Dolayısıyla 4 bağ yapabilir. |
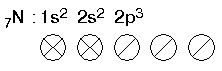 |
Üç bağ yapabilir. Boş orbital olmadığından uyarma yapılamaz. |
 |
2 bağ yapabilir. Boş orbital olmadığından uyarma yapılamaz. |
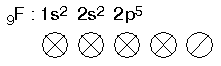 |
1 bağ yapabilir. Boş orbital olmadığından uyarma yapılamaz. |
 |
Yarıdolu orbital olmadığından bileşik yapamaz. |
MOLEKÜL BİÇİMLERİ
- XY türü moleküller
(1A ile 7A, 2A ile 6A, 3A ile 5A)
Moleküller ve bağlar polardır.
Molekül biçimi doğrusal (Açı 180° dir.)
- XY2 türü moleküller
a. X: 2A Y: 7A veya hidrojen ise;
Moleküller apolar, bağlar polar
Molekül biçimi doğrusal (Açı 180°)
Hibritleşme sp dir.
b. X: 4A Y: 2A veya 6A ise:
Molekül apolar, bağlar polar
Molekül biçimi doğrusal (Açı 180°)
Hibritleşme sp dir.
c. X: 6A Y: 1A veya 7A ise;
Molekül ve bağlar polar
Molekül biçimi kırık doğru (Açı 105°)
Hibritleşme sp2 tür.
- XY3 türü moleküller
a. X: 3A Y: 7A veya hidrojen ise;
Moleküller apolar, bağlar polar.
Molekül biçimi düzlem üçgen (Açı 120°)
Hibritleşme sp2 dir.
b. X: 5A Y: 7A veya 1A grubunda ise;
Molekül ve bağlar polar,
Molekül biçimi üçgen piramit (Açı 107°)
Hibritleşme sp3 tür.
- XY4 türü moleküller
(CH4, SiF4, NH4+, SO4–2 gibi)
Molekül apolar, bağlar polar
Molekül biçimi düzgün dörtyüzlü (Açı 109,5°)
Hibritleşme sp3 tür.
İKİLİ VE ÜÇLÜ BAĞLAR
Bazı moleküllerde, iki atom birbirine iki ya da üç bağ ile bağlanabilirler. İki arasındaki ilk oluşan bağ sigma (d) bağıdır. Diğer bağlar ise pi (p) bağıdır. İki atom arasında ikili bağ varsa biri d diğeri p bağıdır. Üçlü bağ varsa bir tanesi d diğerleri p bağıdır.

molekülünde 5 tane sigma bir tane p bağı vardır.
H — N = N — H
molekülünde 3 tane d, 1 tane p bağı vardır.

molekülünde 11 tane d, 1 tane p bağı vardır.
H — C º N
molekülünde 2 tane d, 2 tane p bağı vardır.
H — C º C — H
molekülünde 3 tane d, 2 tane p bağı vardır.
O = C = O
molekülünde 2 tane d, 2 tane p bağı vardır.
Karbon (C) Atomunun Hibritleşmesi
C u 4 bağın tamamını tek bağ olarak yapmışsa, hibritleşmesi sp3 tür.
C unda bir tane 2 li bağ varsa  = hibritleşmesi sp2 dir. Yani bir p bağı var ise
= hibritleşmesi sp2 dir. Yani bir p bağı var ise
hibritleşme sp2 dir. C u 3 lü bağ yapmışsa — C º ya da her iki tarafında 2 li bağ varsa
= C = şeklinde ise hibritleşmesi sp dir. Yani iki tane p bağı bağlı ise hibritleşme sp dir.
MOLEKÜLLER ARASI BAĞLAR
Maddeler gaz halinde iken moleküller hemen hemen birbirinden bağımsız hareket ederler ve moleküller arasında herhangi bir itme ve çekme kuvveti yok denecek kadar azdır.
Maddeler sıvı hale getirildiklerinde ya da katı halde bulunduklarında moleküller birbirlerine yaklaşacağından moleküller arasında bir itme ve çekme kuvveti oluşacaktır. Bu etkileşmeye molekül arası bağ denir. Bu çekim kimyasal bağ tanımına girmez.
Maddelerin erime ve kaynama noktalarının yüksek ya da düşük olması molekül arasında oluşan bağların kuvvetiyle ilişkilidir.
Van Der Waals Çekimleri
Kovalent bağlı apolar moleküllerde (H2, CO2, N2 gibi) ve soygazlarda yoğun fazlarda sadece kütlelerinden kaynaklanan bir çekim kuvveti oluşmaktadır. Bu kuvvete van der waals bağları denir. yoğun fazda sadece van der waals bağı bulunan maddelere moleküler maddeler denir.
Moleküler maddelerin mol ağırlıkları arttıkça kaynama ve erime noktaları yükselir.
Örneğin oda koşullarında F2 ve Cl2 gaz, Br2 sıvı, I2 ise katıdır. Van der waals etkileşimi
en fazla olan I2, en az olan ise F2 dir.
Dipol – Dipol Etkileşimi
Polar moleküllerde (+) ve (–) yüklerin birbirini çekmesiyle oluşan bağlanmadır. Van der waals bağlarından kuvvetlidir. (HF, HCl, H2O)
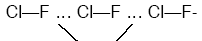
molekül arası bağ dipol-dipol etkileşimi

Molekül arası bağlar dipol-dipol etkileşimi.
(- – – – – – – – -) ile gösterilen bağlardır.
Hidrojen Bağı
Hidrojenin F, O, N gibi elektron ilgisi büyük olan lar ile oluşturduğu (HF, H2O, NH3…) bileşiklerde molekülleri bir arada tutan kuvvete hidrojen bağı denir.
H’nin oksijene bağlı olduğu R — OH (alkol),
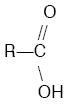 |
(Karboksilli asit) bileşiklerinde molekül arası bağlar, hidrojen bağıdır. |

Oksijen ve hidrojen arasında noktalı olarak gösterilen bağlanma hidrojen bağlarıdır.
Hidrojen bağları van der waals bağlarından ve dipol-dipol bağlarından daha kuvvetlidir.
Ağ Örgülü Kovalent Katılar Arasındaki Bağlar
Yarı metaller veya yarı metallere yakın bazı ametallerin katı hallerinde ortaya çıkan çekim kuvvetidir. Katı silisyum, elmas, grafit gibi kovalent katıların erime noktaları çok yüksektir. Çünkü bu katıların molekülleri arasında ağ örgülü kovalent bağ vardır.

Grafitte Ağ örgüsü Elmasta Ağ örgüsü
İyonik Bağ
İyonik bağlı bileşiklerin hem molekül içi, hem molekül arası bağlanmaları iyoniktir.
İyonik bileşikler oda koşullarında katı halde bulunurlar. Katı halde bulunan iyonik moleküllerde (+) ve (–) yüklü iyonlar birbirine çok yakın olacağından aralarında çekim oluşacaktır. İyonik bileşikler katı halde elektrik akımını iletmezler. Sıvı halde ya da çözündüklerinde elektrik akımını iletirler. Bu katıların kristal yapısı vardır ve kırılgan özelliğe sahiptirler. (NaCl, K2S ……..)
Metal Bağı
Metal atomları arasında oluşan etkileşime metal bağı adı verilir.
- İyonlaşma enerjisi azaldıkça (peryot numarası arttıkça) metalik bağlar zayıflar.
- Değerlik elektronları sayısı artıkça metalik bağ kuvveti artar.
Metalik bağda değerlik elektronları kristal içerisinde hareket ettiğinden dolayı bağlar a değil, kristalin bütününe ait olur. Metaller, değerlik elektronlarının oynaklığından dolayı ısı ve elektrik akımı iletkenliği, şekil verilebilme gibi özelliklere sahip olurlar.

|
işime çok yaradı çok teşekkürler hem ayrıntılı hemde sade bir dille yazılmış
İşallah işe yarar teşekürler .
Adamsınız
Ders notları çok iyimiş tebrik ederim.
Ders notları işime yaradı. Teşekkürler